淋巴细胞低多少为艾滋-淋巴细胞低是怎么回事?
核心的总结一下关于小于1内数值的变化为什么没意义?
1,这个值的高低与抗体的高低,不是线性一元一次方程关系,可能是很复杂的曲线方程关系。特别是在低于1的值,因为都没抗体,所以更不存在高低的说法。都没有讨论高低就没意义。
2,低于1代表没有抗体,那为啥还会有数值?因为本底反应。
就因为本底反应,所以临界值不是从0开始。
当然从技术上是可以把临界值设为从0开始的,比如一个厂家他的临界值是5,那么他可以赋值,比如把临界值赋值为A,6就是A+1,那么A就是0的意思。
但是这样会把医院的医生和患者完全搞懵逼,特别是不同厂家用不同赋值方法。
3,在小于1的数值变化只能说明检测过程中影响因素的变化,也就是本底反应的变化。因为没有抗体所以不存在抗体的变化。
就如你银行里只存了100,然后你PS一个5000000的存折,代表你就有5000000了吗?并不是,最重要是看实质的东西有没改变。
4,化学发光检测抗体,并不是真正的定量检测,他的数值不是代表真实的抗体浓度。所以,在数值小于1时,只能代表阴,高低不能说明其他问题。
在检验医学里,HIV化学发光抗体检测不是真正意义上的定量检测,可以理解为半定量。只是非专业人员喜欢把有数值的结果叫做定量检测。
如病毒载量检测,单位为多少拷贝,那才是真正的定量检测。
定量检测主要的临床意义是指导治疗,指导用药。比如病毒载量上升了,这个说的是实打实的病毒浓度上升了。
核酸检测也分定量检测和定性检测两种,并且定性检测的灵敏度高于定量检测。这是他们的临床意义所决定的。定性最主要是用于筛查或者确诊艾滋感染,而定量是用于已感染者的病情评估,指导治疗。
如果化学发光HIV抗体检测是定量检测,那么他的单位肯定是一个浓度单位,如你报告里的乙肝表面抗原。而不会是S/CO。
所以,艾滋检测,试纸,酶法,化学发光都是定性检测,或者叫半定量。其实试纸也可以通过机器来出数值的,曾经出过此类机器,只是没啥意义,就被淘汰了。机器可以通过T区显色的深浅来出数值,然后判断阴阳。但他方法学的本质还是定性检测。
现在,在比如肺炎支原体,肺炎衣原体抗体试纸检测上还应用比较多,会出一个数值。
那为什么化学发光是半定量呢?因为在大于1以上的值,数值大小还是有一定意义的。后面具体讲。
从题主的报告里,我们还可以看到乙肝表面抗原的检测,医院是特定标注了定量。同时他的单位也是IU/ml
在乙肝两对半的检测里(五项),使用化学发光可以做到2-3项的真正定量,能做到三项的有雅培,罗氏,索林等品牌。
而剩下的两项虽然也出数值但同样不是真正的定量检测。
要明白这个数值的意义,首先你要明白S/CO这个单位代表的意思。
S=sample样本吸光度(样本值)
Co=cutoff临界值。
但是这个值不是说抗体的具体浓度,而是一个光信号值,就是反应化学发出的光的信号值,也可以理解为光强度。
当然,光信号值和抗体浓度是一一对应的,通过定标曲线来对应。
可能有朋友会想为什么不直接用样本值,还多此一举,除以临界值。
是因为直接用样本值会有个问题:
每个厂家的临界值是不一样的,比如A厂是5,B厂是6,一个病人在A和B测出来都是5.5,那么就是一个阳一个阴。那么是不是很懵逼,那么是不是得去和医院闹。
还有就是同一厂家,不同型号的机器,也可能出现临界值不同的问题。
1,因为临界值不会是0,因为会存在本底反应。
就是发光底物,本身会有一个发光强度,我们叫本底反应。
比如一篇文章《利德曼化学发光底物APCL-I性能评测》中就有说:本研究对利德曼公司研制的化学发光底物APCL-I性能进行了全面评测。主要结果为:1、以MODULUS单管发光分析仪检测,底物本底平均相对发光强度(RLU)为540
意思就是说,你拿纯净水去测,测出来的发光强度也不是0,也是540
2,不管你各个厂家临界值是多少,用样本值去除,1的时候都是临界值,大于1就是阳,小于1就是阴。这样就做到了,不同医院用不同品牌产品,参考范围的统一,患者也不用懵逼,特别我们的恐艾朋友。
临界值对于一个试剂来说十分重要,它就是标杆,如果它都错了,后面检测的值也都会错。他的确立也是个复杂工程,如下我就简单介绍两种方法。
1,统计学方法
阴性99或95百分位值作为临界值
比如,最新的国际心梗通用定义中将肌钙蛋白作为心肌损伤检测金标准,并且统一使用正常参考上限(URL)99th百分位值作为临床临界值。
什么意思呢?
比如选择300个确定为阴性的正常人,然后使用机器一一进行血液检测,那么每个人都会得到一个值。然后把这300个值进行从小到大进行排序,那么第297位的这个值就是第99百分位阴性值,这个值就作为临界值。
2,标准品值。
就是有些项目已经有明确的研究证明,某一个值是临界值,那么厂家只需要拿这个值的国际标准品,进行实验,设定自己的临界值就好。
人血清中的IgG
正常人血清中的IgG:IgG浓度对抗体检测有较大的影响,尤其是间接法检测抗体项目。成人血样中的IgG浓度为7~16.5mg/ml,个别样本的IgG浓度会更高,这些样本检测时易显示假阳性。
人血清中异常的 IgG:孕妇怀孕期间会产生特殊抗体;自身免疫性疾病易引起抗体检测假阳性,如:当患有类风湿关节炎、结缔组织病等病症时,血清中的异常IgG升高会引起本底升高或假阳性。
样本处理不当引起
样本中的纤维蛋白原:如果血液样本凝固不完全,血清中仍留部分纤维蛋白原,在化学发光测定过程中,磁微粒和纤维蛋白原形成肉眼可见的纤维蛋白块,易造成高阴或假阳性结果。
样本溶血:样本中红细胞破裂,血红蛋白逸出称红细胞溶解,简称溶血。当检测样本溶血时,血红细胞中的亚铁血红素具有过氧化物酶的作用,其通过吸附或者 “PP” 效应,易引起假阳性免疫反应。
样本染菌:细菌污染样本时,菌体中或细菌分泌物中可能含有某些物质,会产生假阳性反应;
样本保存时间过长:在冰箱中保存时间过长导至血清IgG聚合,易使间接法等的试验本底加深;
操作不当
任何不符合规范的操作都会影响检测结果,因此在实验操作过程中应该严格保证操作的规范性。
严格按照仪器和试剂说明书进行实验操作是得到准确结果的关键。
全自动化学发光平台,已经大大降低了手工操作引起的各种操作问题和实验结果误差,但是仍然有一些需要注意的事项,避免引起本底的升高或者假阳性。
使用样本量不足的样本:当样本量不足,加样模块识别不够精密时,样本中的血红蛋白或凝胶就会被当成样本吸入加样,导至磁微粒凝集成块,造成高阴或假阳性结果。
加样针、反应杯等耗材:加样针、反应杯应保证干净无污染。
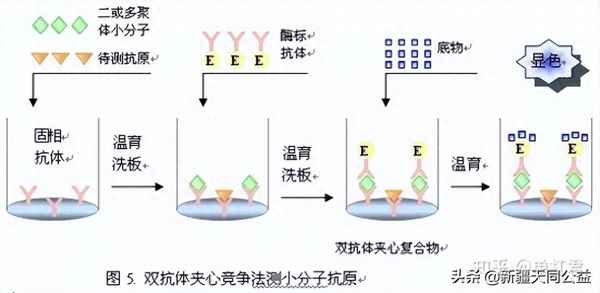
艾滋测抗体原理是一样的,就是用的双抗原夹心法。过程如上图。
1.首先在反应杯壁或者杯内包被了固定抗原,然后把血液加进去。
2,反应孵育一定时间,后加入化学发光标记物的标记抗原。
3,反应孵育一定时间后把多余的未反应的抗原洗走,烘干。
4,然后加入发光底物,进行反应。然后进行光强度检测。通过定标曲线,将检测到的光强度翻译为对应数值,输出结果。
在数值大于1时是有一定的临床意义的
HIV在攻击CD4+T淋巴细胞的过程中同步刺激机体免疫系统产生种类和数量不断变化的抗体[1],而HIV-1抗体阳性者的样本吸光度/临界值(sample/cutoff ratios,S/CO)或免疫印迹试验(Western blot,WB)带型则可以体现这些变化。
当机体处于感染初期,此时的S/CO值较低,但免疫力还维持在较高水平。随着病情进展,机体免疫系统被破坏,产生的抗体水平则会逐渐下降或被病毒大量消耗[2-4]。研究表明,在非重度免疫抑制组中,随着CD4细胞数目的降低,较低的S/CO值(1~6)出现率呈递增趋势。HIV-1感染中期随着机体免疫力恢复,抗体产生也会随之增加。研究表明,在非重度免疫缺陷组中,随着CD4细胞数目的增加,较高S/CO值(10~20)的出现率呈递增趋势[5]。
总结
化学发光代表了目前很多项目的检测技术巅峰,技术也挺高的。
比如对于艾滋检测,有一个很好的优势就是灵敏度更高,这就能避免漏检。不需要手工操作,也避免了人工操作带来的误差或者失误。
现在抗原抗体的联合检测,也大大缩短了窗口期。
核心的总结一下关于小于1内数值的变化为什么没意义?
1,这个值的高低与抗体的高低,不是线性一元一次方程关系,可能是很复杂的曲线方程关系。特别是在低于1的值,因为都没抗体,所以更不存在高低的说法。都没有讨论高低就没意义。
2,低于1代表没有抗体,那为啥还会有数值?因为本底反应。
就因为本底反应,所以临界值不是从0开始。
当然从技术上是可以把临界值设为从0开始的,比如一个厂家他的临界值是5,那么他可以赋值,比如把临界值赋值为A,6就是A+1,那么A就是0的意思。
但是这样会把医院的医生和患者完全搞懵逼,特别是不同厂家用不同赋值方法。
3,在小于1的数值变化只能说明检测过程中影响因素的变化,也就是本底反应的变化。因为没有抗体所以不存在抗体的变化。
就如你银行里只存了100,然后你PS一个5000000的存折,代表你就有5000000了吗?并不是,最重要是看实质的东西有没改变。
4,化学发光检测抗体,并不是真正的定量检测,他的数值不是代表真实的抗体浓度。所以,在数值小于1时,只能代表阴,高低不能说明其他问题。
这是个复杂的问题,希望有把这个问题说清楚。其中专业词汇若有不能理解的,可以点赞评论,我再进行补充。也欢迎大佬指点和探讨。
参考文献:[1] Laeyendecker O, Gray R H, Grabowski M K, et al. Validation of the Limiting Antigen Avidity Assay to Estimate Level and Trends in HIV Incidence in an A/D Epidemic in Rakai, Uganda[J]. AIDS Res Hum Retroviruses, 2019,35(4):364-367.
[2] Longosz A F, Morrison C S, Pai-Lien C, et al. Comparison of Antibody Responses to HIV Infection in Ugandan Women Infected with HIV Subtypes A and D[J]. Aids Research & Human Retroviruses, 2014,31(4):421-427.
[3] Parekh B S, Mcdougal J S. New approaches for detecting recent HIV-1 infection[J]. Aids Reviews, 2001,3(4):183-193.
[4] Wratil P R, Rabenau H F, Eberle J, et al. Comparative multi-assay evaluation of Determine HIV-1/2 Ag/Ab Combo rapid diagnostic tests in acute and chronic HIV infection[J]. 2020.
[5] 林倩茹, 于贺军, 张辉, 等. HIV-1感染者不同免疫状态的抗体及病毒载量研究[J]. 中华实验和临床病毒学杂志, 2021,35(02):147-151.
来源:单杠君
免责声明:本公众号旨在卫生健康公益宣传,不作商业用途。部分素材来源于网络,如有文字、图片、视频或者其他内容涉及侵权或违规,请联系我们进行删除修改,谢谢!